
INTRODUCCIÓN
La silimarina, principio activo del Silybum marianum (Cardo mariano) es un flavonoide que se encuentra constituido por una mezcla de silybina, silidianina y silicristina, que se halla en el vegetal en una proporción del 1.5 al 3% (Bors, et al.,1985; Valenzuela et al., 1988; Zi et al., 1987). El mecanismo de acción de la silimarina frente al daño hepático se basa en la captación de radicales libres al igual que los casi 5000 flavonoides conocidos.
 La silimarina se une a los receptores de membrana del hepatocito y compite con las sustancias toxicas produciendo un efecto estabilizador de membrana y de esta forma neutraliza los radicales libre. Estimula la regeneración del glutatión reducido, considerado como una de las biomoléculas mas importante en la protección celular contra el estrés oxidativo (Bors, W. et al., 1989; Skittova, N et al., 1981) y estimula el metabolismo de la celua hepática activando la formación de ribosomas maduros y por consiguiente la síntesis protéica, como consecuencia aumenta la replicación de ADN y los procesos metabólicos (Halim,
A.B. et al., 1997; Popper, H. et al., 1972; Serrano, E. et al., 1998).
La silimarina se une a los receptores de membrana del hepatocito y compite con las sustancias toxicas produciendo un efecto estabilizador de membrana y de esta forma neutraliza los radicales libre. Estimula la regeneración del glutatión reducido, considerado como una de las biomoléculas mas importante en la protección celular contra el estrés oxidativo (Bors, W. et al., 1989; Skittova, N et al., 1981) y estimula el metabolismo de la celua hepática activando la formación de ribosomas maduros y por consiguiente la síntesis protéica, como consecuencia aumenta la replicación de ADN y los procesos metabólicos (Halim,
A.B. et al., 1997; Popper, H. et al., 1972; Serrano, E. et al., 1998).
La silimarina forma complejos del tipo II con el citocromo P-450 protegiendo frente a xenobióticos que necesitan de una transformación para dar lugar a metabolitos que pueden ser eliminados por vía renal o biliar (Locher, R. et al., 1998; Krapacova, K. et al., 1996).
PROPIEDADES DE LA SILIMARINA
ANTIOXIDANTE
El hígado es el órgano clave del organismo tanto en el metabolismo como en la excreción, por lo que se encuentra expuesto de forma sostenida a la actuación de los xenobióticos; como es bien conocido, las sustancias dotadas de una cierta liposolubilidad han de pasar obligatoriamente por el hígado con el fin de transformarse en otras más hidrosolubles, a través de las reacciones de la fase I (oxidación, hidroxilación, etc.) y de la fase II (formación de sulfo y glucorono-conjugados).
Para ello, las sustancias liposolubles, tras ser absorbidas en el tracto intestinal acceden a la glándula hepática en donde son transformados en sus correspondientes metabolitos hidrosolubles y, por tanto, susceptibles de ser eliminados vía renal. Ahora bien, hay que tener en cuenta que estos metabolitos pueden resultar lesivos en muchos casos para el hígado, ocasionando en el mismo diversas alteraciones. Entre estos metabolitos se encuentran diversos radicales libres de oxígeno y de nitrógeno, los cuales pueden dañar a distintos elementos hepáticos: hepatocitos, células de Kupffer, células estrelladas y células endoteliales.
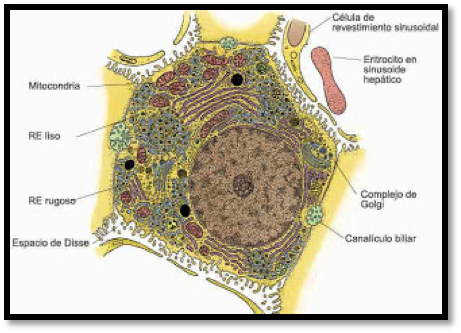 Los radicales libres ocasionan la peroxidación de los componentes lipídicos de la membrana celular a la vez que oxida también a proteínas y ácidos
nucleicos. El conocimiento de los derivados de la actuación de estos radicales libres sobre el organismo y en particular en el hígado, donde alcanzan altas
concentraciones, fue determinante a la hora de plantear por distintos grupos de investigadores el estudio de la potencialidad antioxidante de los extractos
de cardo mariano, la silimarina y su principal componente, la silibinina y, por tanto, de su posible efecto beneficioso en distintas alteraciones hepáticas
en las que se encuentran implicados.
Los radicales libres ocasionan la peroxidación de los componentes lipídicos de la membrana celular a la vez que oxida también a proteínas y ácidos
nucleicos. El conocimiento de los derivados de la actuación de estos radicales libres sobre el organismo y en particular en el hígado, donde alcanzan altas
concentraciones, fue determinante a la hora de plantear por distintos grupos de investigadores el estudio de la potencialidad antioxidante de los extractos
de cardo mariano, la silimarina y su principal componente, la silibinina y, por tanto, de su posible efecto beneficioso en distintas alteraciones hepáticas
en las que se encuentran implicados.
La silimarina presenta actividad antirradicalaria frente a diferentes radicales libres, tales como el 1,1-difenil-picrilhidrazilo (DPPH) y el 2,2-azino-bis (3-etilbenztiazolina-6-ácido sulfónico) (ABTS), a la vez que ha demostrado su acción antioxidante en otros sistemas, por ejemplo por su capacidad de captación de radicales libres de oxígeno y de quelación de aniones ferrosos (Fe2+). Además, la silimarina inhibe en un 82.7% la peroxidación lipídica del ácido linoleico.
El conjunto de los resultados en numerosos ensayos in vitro e in vivo, han permitido demostrar el efecto antioxidante tanto de la silimarina como de la silibinina, las cuales, a pesar de no ser buenos captadores de radical superóxido ni de H2O2, reaccionan rápidamente con el radical hidroxilo, disminuyendo así la peroxidación lipídica. Al mismo tiempo, restauran y potencian las enzimas antioxidantes endógenas superóxido dismutasa (SOD), catalasa y glutatión peroxidasa (GSHPx) en condiciones de estrés oxidativo, condiciones a un incremento de la concentración de glutatión (GSH) intracelular.
Esta actividad antirradicalaria ha sido igualmente puesta de manifiesto en ensayos in vivo en los que los animales de experimentación fueron sometidos a la administración intraperitoneal de tetracloruro de carbono (CCI4), cuyo daño transcurre a través de la formación de radicales libres. El tratamiento con silimarina dio lugar a un descenso altamente significativo de los valores anormalmente elevados de enzimas hepáticas por el CCl 4 a la vez que se incrementaron los niveles de glutatión.
La silimarina actúa como antioxidante debido a que inhibe la formación de radicales libres, se une con distintas especies radicalarias actuando como captador de las mismas, interfiere en la peroxidación de los lípidos de membrana, modulando en consecuencia la permeabilidad de las membranas, e incrementa el contenido intracelular de captadores de radicales.
De hecho, en situaciones de estrés oxidativo y nitrosativo, la silimarina inhibe la formación de radicales superóxido y de óxido nítrico (NO), da lugar a un aumento de ATP a través de la fosforilación del ADP, disminuye el contenido en malondialdehido (MDA) y contrarresta la disminución de distintas enzimas antioxidante: GSH, SOD, catalasa, glutatión peroxidasa y glutatión reductasa de forma dosis dependiente. Por otra parte, en un ensayo realizado con monocitos estimulados con miristato de forbol, la silimarina inhibió la producción de peróxido de hidrogeno.
AUMENTO DE LA ESTABILIDAD DE MEMBRANA: CITOPROTECCIÓN
La silimarina tiene un efecto regulador sobre la permeabilidad de la membrana celular y mitocondrial, asociado a un incremento de la estabilidad de la membrana en caso de daño por xenobióticos. Esto se debe en parte a sus propiedades antioxidante, que disminuyen la unión de los radicales libres a los componentes de dichas membranas.
También se ha visto que actúa directamente sobre los fosfolípidos de membrana, contribuyendo de esta forma a mantener una fluidez normal de la misma.
 Por otra parte, puede prevenir la absorción de toxinas en los hepatocitos por ocupación de los lugares de unión de estas y por inhibición de diversas
proteínas de transporte de membrana. Esto es lo que ocurre con la faloidina y la amanitina, toxinas de Amanita phalloides.
Por otra parte, puede prevenir la absorción de toxinas en los hepatocitos por ocupación de los lugares de unión de estas y por inhibición de diversas
proteínas de transporte de membrana. Esto es lo que ocurre con la faloidina y la amanitina, toxinas de Amanita phalloides.
AUMENTO DE LA SÍNTESIS DE PROTEINAS
La silimarina, produce un notable incremento de ARN microsomal en el hígado. Aún no se conoce el mecanismo exacto, aunque parece estar implicada la activación de la polimerasa I. En estudios preclínicos se ha observado que la silimarina estimula la ARN-polimerasa I y el ARN ribosómico, lo que conduce a una formación más rápida de ribosomas y, por tanto, un aumento de síntesis proteica. Esto tiene gran importancia para la regeneración de las células hepáticas y el normal funcionamiento del hígado.
ACTIVIDAD ANTIFIBRÓTICA
Enfermedades hepáticas crónicas, como la cirrosis, cursan con formación de nódulos fibróticos. La fibrosis produce una remodelación de la arquitectura del hígado y conduce a insuficiencia hepática, hipertensión portal y encefalopatía hepática.
En la fibrogénesis el hecho más importante es la conversión de células estrelladas hepáticas (HSC) en miofibroblastos. Se ha demostrado que la silimarina retarda la activación de las HSC, lo que podría relacionarse con la inhibición que producen sobre la activación del factor nuclear ƙB (NF- ƙB). También se ha demostrado la disminución de la fibrogénesis por el descenso que produce la silimarina sobre la expresión de la α-SMA (Actina muscular alfa).
La α-SMA es considerada un factor importante en la fibrosis hepática, siendo un buen arcador para la detección de miofibroblastos y células estrelladas hepáticas activadas, que preceden a la formación de tejido fibrótico. La reducción en α-SMA se acompaña de disminución en el número de células estrelladas hepáticas activadas y, a su vez, la pérdida de estas células por apoptosis produce disminución de fibrosis del hígado. Por tanto, la disminución de la fibrosis por la silimarina podría deberse a la promoción de la apoptosis de células estrelladas hepáticas activadas.
ACTIVIDAD ANTIINFLAMATORIA E INMUNOMODULADORA
Las actividades antiinflamatorias e inmunomoduladoras de la silimarina están muy relacionadas con su actuación sobre el hígado, puesto que diferentes alteraciones hepáticas cursan con inflamación o están mediadas por el sistema inmune.
Por una parte, se ha demostrado que la silimarina es capaz de inhibir la 5-lipoxigenasa y la liberación de leucotrieno LTB4, en células de Kupffer. Por otra, parece que las bases moleculares de los efectos antiinflamatorios e inmunomoduladores de la silimarina pueden estar relacionadas con la inhibición del NF- ƙB, que regula y coordina la expresión de varios genes implicados en el proceso inflamatorio e inmune.
 La silimarina inhibe de forma dosis dependiente la activación de NF- ƙB y cinasas relacionadas, mediante la supresión de la fosforilación y degradación de
IƙB, bloqueo de la translocación al núcleo de la subunidad p65 y disminución de la transcripción del gen informador dependiente de NF- ƙB.
La silimarina inhibe de forma dosis dependiente la activación de NF- ƙB y cinasas relacionadas, mediante la supresión de la fosforilación y degradación de
IƙB, bloqueo de la translocación al núcleo de la subunidad p65 y disminución de la transcripción del gen informador dependiente de NF- ƙB.
Para la máxima activación trancripcional del NF- ƙB se requiere la fosforilación de la serina NF- ƙB. La inhibición de la activación de NF- ƙB podría justificarse, al menos en parte, porque la silimarina bloquea de forma parcial la fosforilación de Ser536 sobre la subunidad p65 de NF- ƙB. También inhibe parcialmente la translocación del núcleo de las subunidades p50 y p65 de NF- ƙB. Con anterioridad, los mismos autores demostraron que un extracto de silimarina era capaz de inhibir en monocitos previamente estimulados con anti-CD# la expresión del TNF-α. Además, en un ensayo realizado con linfocitos mononucleares y linfocitos T obtenidos a partir de sangre de pacientes con daños hepáticos, se comprobó que la adición de concentraciones mínimas de un preparado normalizado de silimarina inhibía de forma dosis-dependiente, la proliferación y la secreción de TNF-α, γ-interferón e IL2 en los linfocitos mononucleares previamente estimulados con anticuerpos monoclonales de lipopolisacáridos (LPS) que afectan al hígado.
ACTIVIDAD ANTICOLESTÁSICA
La colestasis consiste en el impedimento total o parcial para la llegada de bilis al duodeno, ya sea por incapacidad para su formación por el hígado o para su flujo por los conductos biliares.
 Una serie de estudios han puesto de manifiesto la actividad anticolestásica de la silimarina, principalmente frente a modelos experimentales de colestasis
inducida por estrógenos y por taurolitocolato. Se demostró en principio que la silimarina, en condiciones fisiológicas, producía un aumento del flujo
biliar y de sales biliares, principalmente aquellas que presentan propiedades hepatoprotectoras como el α y β-muricolato y ursodesoxicolato. Esto suponía
un incremento en el tamaño del pool endógeno de sales biliares.
Una serie de estudios han puesto de manifiesto la actividad anticolestásica de la silimarina, principalmente frente a modelos experimentales de colestasis
inducida por estrógenos y por taurolitocolato. Se demostró en principio que la silimarina, en condiciones fisiológicas, producía un aumento del flujo
biliar y de sales biliares, principalmente aquellas que presentan propiedades hepatoprotectoras como el α y β-muricolato y ursodesoxicolato. Esto suponía
un incremento en el tamaño del pool endógeno de sales biliares.
En la colestasis inducida por estrógenos, la silimarina consigue normalizar los niveles incrementados de fosfatasa alcalina (ALP), considerada un marcador sérico de la colestasis, y aumenta el flujo de bilis y de sales biliares al igual que ocurría en condiciones fisiológicas.
Además, provoca un incremento en la excreción biliar de HCO3, lo que indica que actúa también sobre la fracción de flujo biliar independiente de sales biliares.
La silimarina aumenta el tamaño del pool de las sales biliares, en concreto muricolatos y ursodesocicolato, como en casos anteriores, y favoreció la excreción biliar de taurolitocolato, debido posiblemente a la mejora que produce en el sistema de transporte de sales biliares a nivel canalicular. Esta mejora se explica por la actuación que tiene la silimarina sobre la bomba expulsora de sales biliares hacia la bilis (Bsep). No se llega a un acuerdo sobre el mecanismo de acción, pero la idea con más fuerza es la que muestra que la silimarina es un potente inhibidor de la fosfodiesterasa, lo que daría lugar a un incremento en los niveles de AMPc, que sería el responsable directo de proteger la Bsep de posibles cambios, debido a que favorece la inserción de esta bomba en la membrana canalicular de los hepatocitos.
Por otra parte, en la actividad anticolestásica de la silimarina también es importante la capacidad antioxidante que presenta, puesto que los radicales libres parecen estar implicados en la patogénesis de la colestasis extrahepática.
EFECTO SOBRE EL HUESO
 Ha sido demostrado por Seidlova –Wuttke et al, que la administración de silimarina a los animales de experimentación daba lugar a un incremento del TGFβ1,
factor implicado en la actividad proliferativa de los osteoblastos derivada de la estimulación de los receptores estrogénicos presente en el hueso. Por
otra parte, los resultados procedentes de distintas investigaciones han mostrado el efecto inhibitorio de la silimarina sobre la osteoclastogénesis. Esta
actuación de la silimarina en la formación de los osteoclastos se encontraría mediada por su efecto inhibitorio sobre dos factores que desempeñan un
importante papel en este proceso, el RANKL y el TNF-α, cuya activación da lugar a una cascada de señales implicadas en la formación de los osteoclastos. En
el caso del RANKL, su inhibición por la silimarina es debido, al menos en parte, a la supresión de la expresión del factor de transcripción NFATc1 asi como
de la del receptor asociado al osteoclasto (OSCAR), los cuales favorecen a la osteoclastogénesis a través de una regulación positiva del RANKL.
Ha sido demostrado por Seidlova –Wuttke et al, que la administración de silimarina a los animales de experimentación daba lugar a un incremento del TGFβ1,
factor implicado en la actividad proliferativa de los osteoblastos derivada de la estimulación de los receptores estrogénicos presente en el hueso. Por
otra parte, los resultados procedentes de distintas investigaciones han mostrado el efecto inhibitorio de la silimarina sobre la osteoclastogénesis. Esta
actuación de la silimarina en la formación de los osteoclastos se encontraría mediada por su efecto inhibitorio sobre dos factores que desempeñan un
importante papel en este proceso, el RANKL y el TNF-α, cuya activación da lugar a una cascada de señales implicadas en la formación de los osteoclastos. En
el caso del RANKL, su inhibición por la silimarina es debido, al menos en parte, a la supresión de la expresión del factor de transcripción NFATc1 asi como
de la del receptor asociado al osteoclasto (OSCAR), los cuales favorecen a la osteoclastogénesis a través de una regulación positiva del RANKL.
NEUROPROTECCIÓN
Los depósitos de péptidos β-amiloides se encuentran íntimamente asociados al estrés oxidativo y a la respuesta inflamatoria neuronal. La demostrada actividad antioxidante y reductora de la respuesta inflamatoria de la silimarina ha dado lugar al planteamiento de distintas investigaciones en las que se ha intentado poner de manifiesto los mecanismos a través de los cuales podría transcurrir su posible efecto neuroprotector frente al año inducido por el β-amiloide.
En un modelo animal de daño isquémico agudo, en el que se estudió el posible efecto protector de la silimarina frente a las consecuencias de las isquemia/repercusión, se observó que la silimarina reducía, de forma dosis dependiente, la aparición de infarto cerebral entre un 16 y un 40% y que mejoraba los déficits neuronales en los animales sometidos al tratamiento con silimarina. Además, se constató que determinados marcadores relacionados con el daño neuronal por isquemia/reperfusión como son los peróxidos lipídicos, las proteínas nitrosiladas y el estrés oxidativo, se encontraban disminuidos en el grupo de animales tratados con silimarina. Igualmente se observó una disminución en la expresión de determinadas enzimas asociadas al proceso inflamatoria (iNOS, COX, MPO) y de ciertos factores trancripcionales como NF- ƙB, STAT-1, así como de la producción de citoquinas proinflamatorias (IL-1, TNF-α).
BIBLIOGRAFÍA
Copyright © 2016 Pronutron - Designed by PeruDevOps.
